Содержание
В биологии белки — природные высокомолекулярные органические соединения, выстроенные из остатков 20 аминокислот, соединённых пептидными связями в полипептидные цепи. На протяжении жизни всех организмов они выполняют структурную, регуляторную, каталитическую, транспортную, защитную, энергетическую и иные функции. Классификация белков в большей степени обусловливается и строится на различных, зачастую случайных, признаках.
О классификации белков
Сложность построения и большие размеры молекул, колоссальное многообразие функций белков делает трудной задачей разработку единой и чёткой их классификации на какой-то одной основе и не позволяет разделить их, не исключив некоторые уникальные белки. Классифицировать возможно по их составу, функциям и структуре.
Классификация по сложности
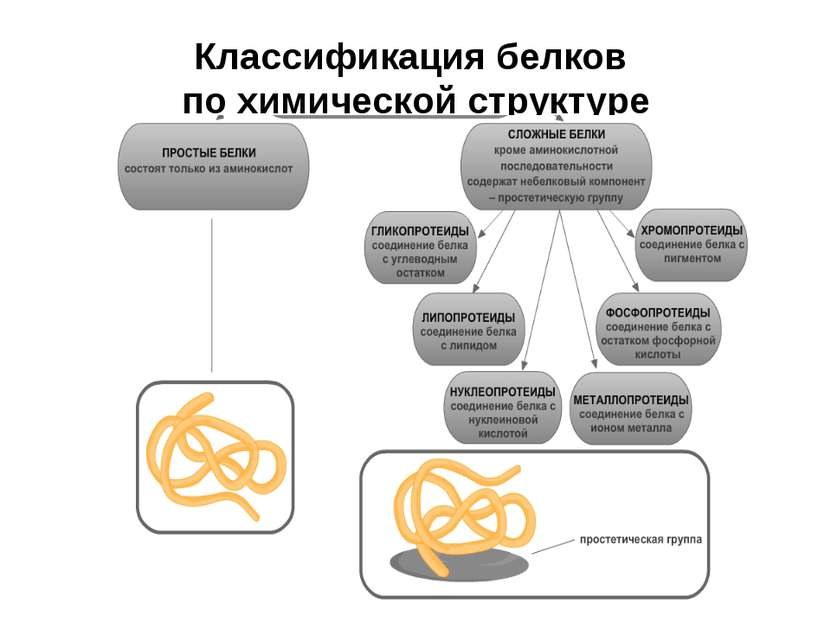
В биохимии, исходя из уровня сложности строения, их принято делить на 2 группы — простые и сложные белки. Первые классифицируют еще по растворимости.
Классификация простых белков:
- альбумины — хорошо растворяемые в воде, растворах солей различных концентраций, щелочах и кислотах;
- глобулины — слабогидрированные вещества. Они растворяются в разбавленных нейтральных солях небольших концентраций, щелочах и кислотах, но они не растворимы в воде;
- протамины – низкомолекулярные щелочные белки. В их состав входит до 80% лизина и аргинина. Они хорошо растворяются в воде, кислой, нейтральной и в щелочной средах;
- проламины растворяются в разбавленном (60-80%) этаноле, слабых кислотах и щелочах, но они устойчивы к воде, солевым растворам, а также абсолютному этиловому спирту. Их хорошая растворимость в этаноле связана с неполярностью радикала пролина;
- глютелины — белки, растворимые в слабых (0,1-0,2%) растворах кислот и щелочей, но устойчивы к воде, спиртовым и солевым растворителям.
За пределами данной классификации простых белков расположены те, которые обладают сильной устойчивостью ко всем указанным растворителям. К примеру, протеиноиды — белки опорных тканей.
Классификация сложных белков:
- гликопротеиды имеют в своем составе углеводный элемент. Эти вещества присутствуют во всех тканях живых организмов и растений;
- липопротеиды — сложные белково-липидные структуры. К примеру, они служат структурной основой мембран клетки;
- хромопротеиды — белки красного цвета и флавопротеиды — желтого. В их составе присутствуют ионы металлов и витамин В2;
- фосфопротеиды содержат связанные ковалентно остатки фосфорной кислоты;
- металлопротеиды содержат негемовые и связанные по расположению ионы металлов;
- нуклеопротеиды принимают участие в биологических процессах главного звена, которое служит основой работы любого организма.
Классификация по форме
В основе классификации по форме лежит соотношение продольной и поперечной осей. Выделяют 2 группы:
- к глобулярным относятся вещества, у которых такое соотношение не превышает 1:10 и имеет эллипсоидную форму. Они включают ферменты, иммуноглобулины, определённые гормоны белковой природы (например, инсулин);
- фибриллярные обладают вытянутой, нитевидной структурой, в которой соотношение осей превышает 1 к 10. Например, протеиноиды, осуществляющие в организме структурную функцию, или миозин, который участвует в сокращении мышц.
Классификация белков по функциям
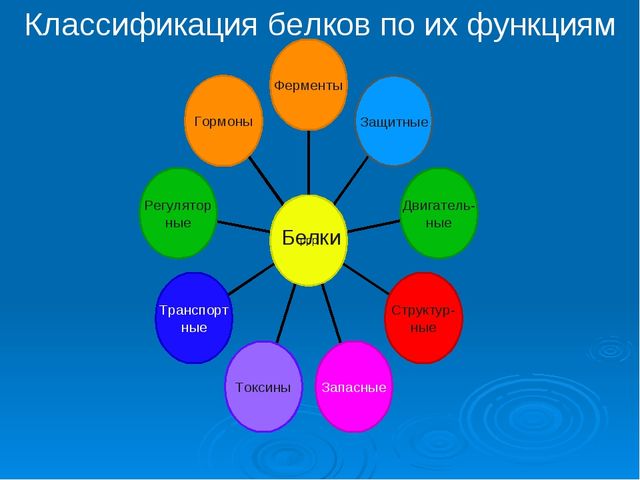
В зависимости от функций белки делятся на:
- ферменты;
- транспортные;
- структурные;
- сократительные;
- регуляторные (гормональные);
- защитные;
- запасающие белки.
По какому признаку белки делятся на простые и сложные
Принцип такого деления основан на сложности строения белков и количестве элементов распада. Простые отличаются от сложных количеством компонентов, на которых они строятся и разницей в продуктах распада при гидролизе. У сложных белков молекулы построены из небелковых субстанций и представлены, к примеру, углеводами, нуклеиновыми кислотами, липидами.
Примеры простых белков:
- проламины содержатся, в основном, в семенах злаков. Например, глиадин пшеницы, секалин ржи;
- протеин содержится в яйцах, мясе, рыбе и молоке;
- протамины содержатся в составе молоки рыб, например, клупеин (сельдь), скумбрин;
- альбумины: яйца курицы и сывороточный. К ним также относят рицин семян клещевины, лейкозин зародыша зерна пшеницы;
- глобулины входят в состав семян бобовых и масличных культур, например, вицилин (горох), фазеолин (фасоль), арахин (арахис);
- глютелины имеются, как правило, в семенах злаков — оризенин риса и глютенин пшеницы;
- к протеноидам относятся, например, кератины, эластин, фибрин, коллаген. Коллаген чрезвычайно широко представлен в организме и занимает порядка одной трети его белков. Имеется в составе соединительной ткани. Из кератинов состоят ногти и волосы. Эластин — белок эластичных волокон, связок и сухожилий. Фибрин способствует свёртываемости крови в организме.
Примеры сложных белков:
- группа липопротеидов. Хиломикроны формируются в слизистой кишечника. Липопротеиды образуются в печени и в кровяной сыворотке;
- группа гликопротеидов. Муцины находятся в секрециях слизистых желез. Мукоиды образуются в опорных тканях. Иммуноглобулины и трансферрины имеются в кровяной плазме;
- к фосфопротеидам относится казеин, овальбумин и вителлин;
- металлопротеиды включают гемоцианин и гемэритрин, транспортирующие кислород у беспозвоночных животных, а также ферритин, содержащийся в печени, костном мозге и служащий запасом железа;
- к нуклеопротеидам относятся дезоксирибонуклепротеиды, содержащиеся в ядрах клеток, – основа хроматина и рибонуклеопротеиды, из которых состоят многие вирусы, рибосомы;
- к хромопротеидам относятся цитохромы, переносящие электроны при клеточном дыхании, фотосинтезе, ферменты — каталаза, пероксидаза, разрушающие ядовитую перекись водорода и разлагающие её на кислород и воду. Также сюда включаются гемоглобин и миоглобин, которые у позвоночных располагаются в эритроцитах, а у беспозвоночных — в кровяной плазме. Они обеспечивают кислородом ткани организма.
По какому признаку белки делятся на простые и сложные
Принцип такого деления основан на сложности строения белков и количестве элементов распада. Простые отличаются от сложных количеством компонентов, на которых они строятся и разницей в продуктах распада при гидролизе. У сложных белков молекулы построены из небелковых субстанций и представлены, к примеру, углеводами, нуклеиновыми кислотами, липидами.
Примеры простых белков:
- проламины содержатся, в основном, в семенах злаков. Например, глиадин пшеницы, секалин ржи;
- протеин содержится в яйцах, мясе, рыбе и молоке;
- протамины содержатся в составе молоки рыб, например, клупеин (сельдь), скумбрин;
- альбумины: яйца курицы и сывороточный. К ним также относят рицин семян клещевины, лейкозин зародыша зерна пшеницы;
- глобулины входят в состав семян бобовых и масличных культур, например, вицилин (горох), фазеолин (фасоль), арахин (арахис);
- глютелины имеются, как правило, в семенах злаков — оризенин риса и глютенин пшеницы;
- к протеноидам относятся, например, кератины, эластин, фибрин, коллаген. Коллаген чрезвычайно широко представлен в организме и занимает порядка одной трети его белков. Имеется в составе соединительной ткани. Из кератинов состоят ногти и волосы. Эластин — белок эластичных волокон, связок и сухожилий. Фибрин способствует свёртываемости крови в организме.
Примеры сложных белков:
- группа липопротеидов. Хиломикроны формируются в слизистой кишечника. Липопротеиды образуются в печени и в кровяной сыворотке;
- группа гликопротеидов. Муцины находятся в секрециях слизистых желез. Мукоиды образуются в опорных тканях. Иммуноглобулины и трансферрины имеются в кровяной плазме;
- к фосфопротеидам относится казеин, овальбумин и вителлин;
- металлопротеиды включают гемоцианин и гемэритрин, транспортирующие кислород у беспозвоночных животных, а также ферритин, содержащийся в печени, костном мозге и служащий запасом железа;
- к нуклеопротеидам относятся дезоксирибонуклепротеиды, содержащиеся в ядрах клеток, – основа хроматина и рибонуклеопротеиды, из которых состоят многие вирусы, рибосомы;
- к хромопротеидам относятся цитохромы, переносящие электроны при клеточном дыхании, фотосинтезе, ферменты — каталаза, пероксидаза, разрушающие ядовитую перекись водорода и разлагающие её на кислород и воду. Также сюда включаются гемоглобин и миоглобин, которые у позвоночных располагаются в эритроцитах, а у беспозвоночных — в кровяной плазме. Они обеспечивают кислородом ткани организма.
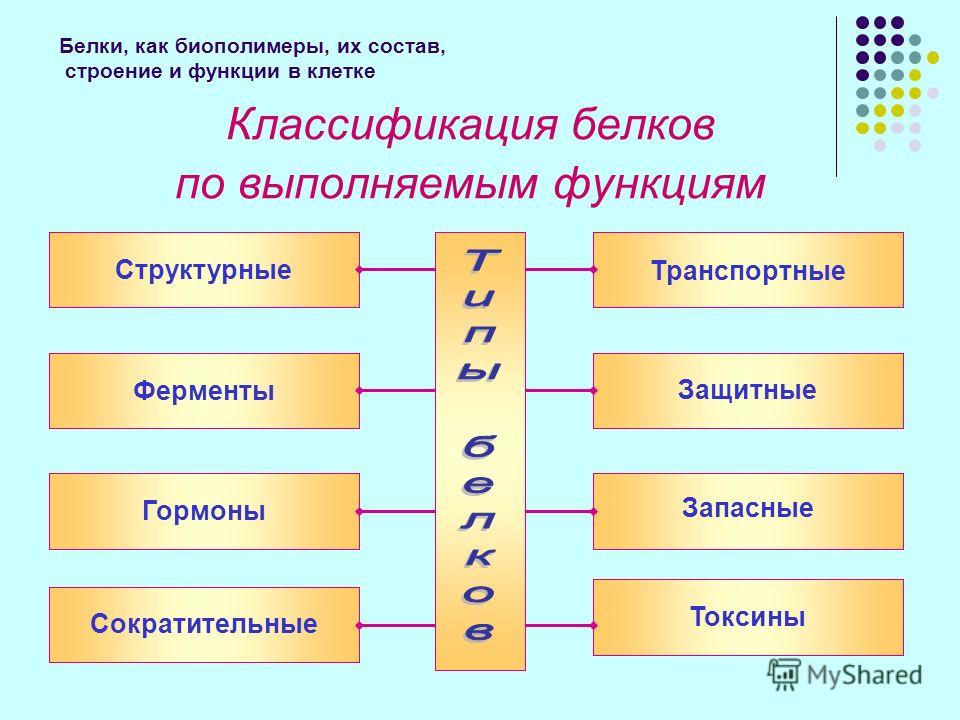
О функциональных классах
Краткий обзор функциональных классов белков:
- ферменты — группа белков, повышающих скорость течения химических реакций. Сюда относятся, например, трипсин и пепсин;
- транспортные выполняют задачу переноса атомов, молекул, ионов как внутри клетки, так и между ними в многоклеточных организмах. Они включают, например, альбумин и гемоглобин;
- пищевые (запасные) предназначены для обеспечения полезными веществами зародышей растений и животных на начальных стадиях их развития, например, казеин и альбумин;
- сократительные (двигательные) обеспечивают клетку или организм способностью сокращаться, менять форму и передвигаться (актин и миозин);
- структурные белки формируют волокна, навитые друг на друга или уложенные плоским слоем, исполняющие опорную или защитную функцию, скрепляющие биологические структуры организмов и обеспечивающие им прочность, например, кератин и коллаген;
- защитные охраняют организм от вторжения инородных живых структур или предохраняют его от повреждений. Например, фибриноген, тромбин;
- регуляторные участвуют в клеточной или физиологической активности, например, инсулин и гормон роста.
О функциональных классах
Краткий обзор функциональных классов белков:
- ферменты — группа белков, повышающих скорость течения химических реакций. Сюда относятся, например, трипсин и пепсин;
- транспортные выполняют задачу переноса атомов, молекул, ионов как внутри клетки, так и между ними в многоклеточных организмах. Они включают, например, альбумин и гемоглобин;
- пищевые (запасные) предназначены для обеспечения полезными веществами зародышей растений и животных на начальных стадиях их развития, например, казеин и альбумин;
- сократительные (двигательные) обеспечивают клетку или организм способностью сокращаться, менять форму и передвигаться (актин и миозин);
- структурные белки формируют волокна, навитые друг на друга или уложенные плоским слоем, исполняющие опорную или защитную функцию, скрепляющие биологические структуры организмов и обеспечивающие им прочность, например, кератин и коллаген;
- защитные охраняют организм от вторжения инородных живых структур или предохраняют его от повреждений. Например, фибриноген, тромбин;
- регуляторные участвуют в клеточной или физиологической активности, например, инсулин и гормон роста.
Белки просто незаменимы в поддержании жизни организма, а также служат его защитой. Установить, к какому классу принадлежат белки, бывает затруднительно из-за уникальности функций некоторых из них. В последнее время осуществляются попытки организовать белки в семейства и описать их домены и мотивы.